化妆品新政88号文出台,使近年的化妆品市场充满活力,众多国内品牌与国外品牌化妆品纷纷进入中国消费者的视野。据调查对于消费者而言,70%以上的客户希望了解化妆品原料的功效信息;对于化妆品厂商而言,安全无毒而又新颖的原料是产品宣传的传统“亮点”。在化妆品研发之初,需要首先判断化妆品原料是否可以合规添加,如果未来计划在华销售,某些不可或缺的原料成分却尚未列入中国的化妆品可使用原料清单,这样的产品即使研发出来,也是不允许在华销售的,需要先完成化妆品新原料的申报才能进行成品的申报。
所以在此为大家介绍一下中国化妆品新原料行政许可申报的相关法规、申报流程以及近年来的法规趋势,以让更多的业内人士了解情况,将更多更好的原料在中国实现合规申报,合法销售和使用。
化妆品新原料定义与申请人
化妆品新原料是指国内首次使用于化妆品生产的天然或人工原料。
国产化妆品新原料行政许可申请人应是化妆品原料生产企业或化妆品生产企业;进口化妆品新原料行政许可申请人应是进口化妆品新原料生产企业或化妆品生产企业。
主管当局
决定机构:国家药品监督管理局
受理机构:国家药品监督管理局保健食品审评中心
其他相关机构:
中国环境保护部:监管在中国境内生产或进口销售新化学物质,含化妆品原料或中间体;海关和出入境检验检疫局:进出口清关检验检疫。
相关法规
《化妆品新原料申报与审评指南》、
《化妆品卫生监督条例》、
《化妆品卫生监督条例实施细则》、
《健康相关产品卫生行政许可程序》、
《化妆品行政许可申报受理规定》、
《化妆品行政许可受理审查要点》、
《化妆品新原料审批服务指南》
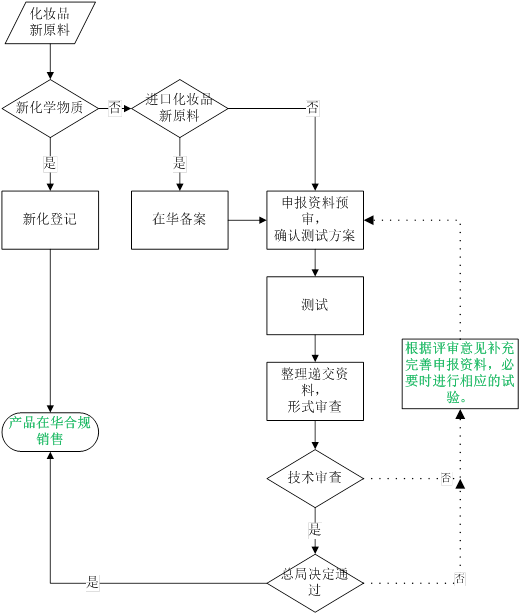
登记流程
化妆品新原料行政许可申报资料要求
1)化妆品新原料行政许可申请表;
2)研制报告;
3)生产工艺简述及简图;
4)原料质量安全控制要求;
5)毒理学安全性评价资料(包括原料中可能存在安全性风险物质的有关安全性评估资料);
6)进口化妆品新原料申请人,应提交已经备案的行政许可在华申报责任单位授权书复印件及行政许可在华申报责任单位营业执照复印件并加盖公章;
7)可能有助于行政许可的其他资料。另附送审样品1件。
未来趋势
近年来批准的化妆品新原料屈指可数。我国对化妆品原料采取严格的管理措施,这与美国和欧盟等大部分发达国家类似。在现今化妆品新原料管理体系下,化妆品新原料注册难度大、周期长。企业若使用未经批准的化妆品新原料责任较大:依据情节轻重,会处违法所得的3到10倍罚款,或5年内不受理相关责任人及企业提出的化妆品许可申请。
2014年开始,CFDA不再发布化妆品新原料审批公告,而是向批准的化妆品新原料申请人发放《化妆品新原料试用批件》,批件设立一定有效期。核准范围以外的其它企业如需使用该原料生产化妆品必须另行向CFDA申报。首先申请批件的企业一旦通过审批,可以利用保护期在竞争激烈的化妆品市场上获得先机。
2018年为进一步做好化妆品注册备案管理工作,国家药监局对美国个人护理产品协会(PCPC)出版的《国际化妆品原料字典和手册(第16版)》(International Cosmetic Ingredient Dictionary and Handbook(2016 Sixteenth Edition))进行翻译,形成了《国际化妆品标准中文名称目录(2018版)(征求意见稿)》,此意见稿包括22620种物质;此目录的更新有利于全球化妆品及原料成分标识信息的统一,也能看出中国化妆品新原料的品种数(目前只有8783种)有很大的上升空间。但根据当前中国化妆品法规要求,企业仍需要依据IECIC(2015)目录中的8783个成分判断是否属于化妆品新原料。
推测化妆品新原料未来几年会有如下的趋势:数量上会有一定的新增;审批制度方面预计会根据产品安全评估难度的不同级别给予分类管理,使更多的好的原料尽快通过申报;监管制度方面预计会建立相对完善的新原料追溯制度和安全风险信息搜集制度,政府机构加大事中事后监管职能,让企业更好的为产品质量安全负责。